Apnées et hypopnées centrales du sommeil : points-clés des recommandations 2024 à paraître
Nathalie RaffierAUTEURS ET DÉCLARATIONS
14 février 2024
Lille, France – Le syndrome d’apnées et hypopnées centrales du sommeil (SAHCS) se distingue de son homologue obstructif par sa physiopathologie, ses étiologies et une stratégie thérapeutique bien distinctes.
Le consensus français relatif aux Syndromes d’Apnées et Hypopnées Centrales du Sommeil (SAHCS) chez l’adulte, en cours de publication, a été présenté en avant-première lors du 28e Congrès de pneumologie de langue française (26-28 janvier 2024, Lille) [1] par la Dre Sandrine Launois-Rollinat, pneumologue, au nom du groupe de travail.
51 recommandations
Le nouveau consensus français 2024 sur les syndromes d’apnées et d’hypopnées centrales du sommeil (SAHCS) de l’adulte comporte 51 recommandations allant du diagnostic au traitement, en passant par le bilan étiologique. Il est proposé par la Société de pneumologie de langue française, le Groupe sommeil de la SPLF, la Société française de cardiologie (SFC), la Société Française de Recherche et Médecine du Sommeil (SFRMS) et la Société de physiologie.
Le diagnostic du SAHCS inclut la plainte clinique
« S’il n’y a pas de réel changement concernant la définition du SAHCS, en termes d’index seuil ni de pourcentage d’événements centraux, nous avons cependant souligné l’importance d’une plainte clinique associée à une somnolence nocturne ou diurne, ce qui nous semble très important », précise Sandrine Launois-Rollinat.
Le syndrome d’apnées et hypopnées centrales du sommeil est défini par l’association des 3 critères suivants :
- L’Indice d’Apnées-Hypopnées (IAH) central > 5/heure de sommeil ou d’enregistrement ;
- Nombre total d’apnées et/hypopnées centrales > 50 % du nombre total ;
- Plainte clinique avec une symptomatologie nocturne ou diurne.
La définition de l’hypopnée est celle de l’AASM 2012
« Nous avons adopté la définition de l’hypopnée de l’American Academy of Sleep Medicine (AASM) 2012, impliquant une diminution de plus de 30 % d’un signal de débit aérien naso-buccal validé pendant au moins 10 secondes, associée à une désaturation ou un micro-éveil. »
L’hypopnée est définie par :
- La diminution de > 30 % du signal de débit aérien naso-buccal validé pendant au moins 10 secondes ;
- Associée à une désaturation > 3 % ou à un micro-éveil.
- Références
Toute respiration périodique n’est pas du Cheyne-Stokes
- La respiration périodique présente des aspects crescendo-decrescendo de la respiration, séparés par des apnées ou des hypopnées, indépendamment de son origine.
- La respiration Cheyne-Stokes se distingue par un IAH central > 5/h, une durée du cycle > 40 secondes et une durée de la respiration périodique > 2 heures.
La respiration périodique se caractérise par un aspect crescendo de la respiration, avec la présence d’apnées ou d’hypopnées, indépendamment de leur origine. Il peut s’agir d’une respiration périodique au moment de l’endormissement, en altitude ou due à une insuffisance cardiaque, entre autres. En ce qui concerne la respiration Cheyne-Stokes, il s’agit d’une forme de respiration périodique caractérisée par un IAH central supérieur à 5/heure et, surtout, une durée de cycle égale ou supérieure à 40 secondes. La durée du cycle est étroitement liée à la sévérité de l’insuffisance cardiaque, et il est crucial que la présence de cette respiration périodique soit significative, dépassant les 2 heures d’enregistrement.
Lors de l’enregistrement, toutes les informations pertinentes, y compris celles liées à la ventilation périodique, doivent être explicitées dans le compte rendu de polygraphie ou de polysomnographie.
Caractériser les hypopnées, est-ce obligatoire ?
Il est recommandé de caractériser le mécanisme central ou obstructif des hypopnées dès le début du codage. Que ce soit lors de l’enregistrement d’un patient connu pour être insuffisant cardiaque, prenant de la méthadone, souffrant d’une insuffisance rénale ou ayant subi un AVC, ou lors du codage d’un patient présentant une suspicion de SAS obstructif, la caractérisation des hypopnées est indispensable.
Devant une hypopnée centrale, les critères évocateurs sont :
- La reprise ventilatoire progressive avec un aspect crescendo de la ventilation (elle est plutôt brutale en cas d’hypopnées obstructives).
- En polysomnographie, un microéveil cortical survenant au moment du pic du crescendo de la ventilation (plutôt au moment de la reprise pour un évènement obstructif).
- La survenue plus fréquente en sommeil lent sur une polysomnographie, de manière majoritaire.
- L’aspect symétrique de la courbe de désaturation-resaturation.
Quel examen diagnostique privilégier pour un SAS central ?
La Dre Sandrine Launois-Rollinat résume l’aspect diagnostic du SAHCS : « attention, il n’existe plus qu’une seule définition de l’hypopnée, ce qui peut conduire à une sous-estimation des indices d’apnées/hypopnées sur les polygraphies ventilatoires. La caractérisation des hypopnées est indispensable pour affirmer la présence d’une composante centrale, nécessitant une proportion de plus de 50 % d’événements centraux. Dans le cas d’un SAHS combiné, caractérisé par des événements centraux et obstructifs, la proportion peut influencer la gravité et la compréhension du trouble. La caractérisation des apnées, bien que souvent complexe, repose sur un faisceau d’arguments, et la relecture de l’enregistrement diagnostique peut être nécessaire, surtout si le patient ne présente aucune amélioration sous traitement. Concernant le diagnostic du SAHS central, s’il n’y a aucune ambiguïté dans les résultats de la polygraphie, une polysomnographie peut ne pas être nécessaire. Les recommandations soulignent l’importance de l’analyse sémiologique de la ventilation pendant le sommeil, offrant déjà des indications étiologiques. »
Le bilan étiologique : que rechercher de manière systématique ?
En présence d’un SAHCS, la recherche systématique d’étiologies cardiovasculaires, neurologiques ou iatrogènes (opiacées, agonistes du récepteur GABA-B, ticagrelor) est systématique. La recherche d’une étiologie cardiaque, en particulier l’insuffisance cardiaque gauche et/ou la fibrillation atriale, doit être fondée initialement sur le relevé de symptômes, des facteurs de risque et antécédents ainsi que sur la réalisation systématique d’un ECG au repos. Des examens complémentaires seront envisagés en fonction des premiers éléments d’orientation, mais en l’absence d’anomalie, il n’est pas recommandé de réaliser des explorations complémentaires (pro-BNP, échocardiographie, holter rythmique).
Prise en charge thérapeutique : qui traiter ?
- Avant d’initier un traitement ventilatoire pour un patient présentant un SAHCS et afin de guider le choix du mode ventilatoire (ventilation à double niveau de pression/VNDP versus ventilation auto-asservie/VAA, en fonction de l’étiologie), il est recommandé de réaliser systématiquement une gazométrie artérielle.
- Avant d’initier un traitement ventilatoire pour un patient présentant un SAHCS, il est indispensable de réaliser systématiquement une échocardiographie pour mesurer la fraction d’éjection ventriculaire gauche, du fait de la contre-indication de la ventilation auto-asservie si la FEVG < 45 %.
L’arbre décisionnel en 2024
Pour toutes les étiologies – y compris dans les SAHCS idiopathiques et médicamenteux – on peut mettre en place une ventilation auto-asservie (VAA) en 1ère intention. Si on envisage une VAA, un bilan pré-thérapeutique est incontournable, car la FEGV < 45 % demeure une contre-indication, ainsi que la gazométrie, la ventilation à double niveau de pression (VNDP) s’imposant en cas d’hypercapnie.
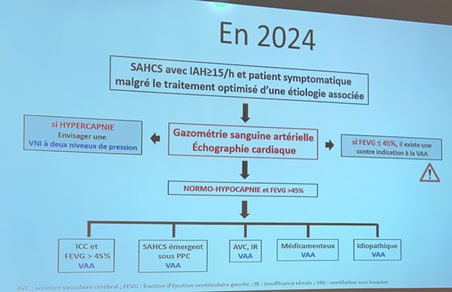
Le suivi clinique revêt une importance capitale. Si les symptômes persistent sans amélioration notable, la poursuite de la ventilation auto-asservie peut ne pas être justifiée dans cette population particulièrement fragile.
Les données issues des machines fournissent un index d’apnées/hypopnées résiduel (IAH débit), qui doit être couplé systématiquement à l’analyse des courbes de débit détaillées pour valider l’IAHdébit proposé par la machine. Ceci permet d’ajuster le traitement en fonction de la réalité clinique, souvent divergente des données « machine ».
Une fois le traitement optimisé, la confirmation objective de la régression de l’IAH nécessite un enregistrement du sommeil (polygraphie/polysomnographie) avec un codage manuel complet. La surveillance régulière de la fraction d’éjection ventriculaire gauche est également essentielle.
Le Dre Sandrine Launois-Rollinat déclare les liens d’intérêts suivants : Investigatrice pour des protocoles de recherche clinique financés par NYXOAH, RESMED, ISIS Médical ; Invitation à des congrès par Oxyvie, Vitalaire, S2A Santé, UCB Pharma, SOS Oxygène, Jazz, Bioprojet, ISIS Médical ; Participation à des formations et ayant donné des formations rémunérées par Les Ateliers d’Arcachon, Cidelec, Philips, Resmed, Zambon, SOS oxygène, Vitalaire, Air Liquide ; Activité de consulting pour Bioprojet, Odorsia, Vifor Pharma