https://www.mdpi.com/2035-8377/16/2/28
Décoder la fatigue post-virale : le rôle complexe des noyaux gris centraux dans le long COVID
par
Thorsten Rudroff 1,2
1Département de santé et de physiologie humaine, Université de l’Iowa, Iowa City, IA 52242, États-Unis
2Département de neurologie, hôpitaux et cliniques de l’Université de l’Iowa, Iowa City, IA 52242, États-Unis
Neurol. Int. 2024 ,
16 (2), 380-393 ;
https://doi.org/10.3390/neurolint16020028
Soumission reçue : 20 février 2024 /
Révisé : 20 mars 2024 /
Accepté : 26 mars 2024 /
Publié : 28 mars 2024(Cet article appartient au numéro spécial
COVID-19, Neuroinflammation and Therapeutics, 2e édition )
Téléchargerclavier_arrow_down
Parcourir les chiffres
Remarques sur les versions
Abstract
La longue COVID afflige des millions de personnes dans une fatigue incessante, perturbant la vie quotidienne. L’objectif de cette revue narrative est de synthétiser les preuves actuelles sur le rôle des noyaux gris centraux dans la fatigue due à une longue COVID, de discuter des mécanismes potentiels et de mettre en évidence les interventions thérapeutiques prometteuses. Une recherche documentaire complète a été menée à l’aide des bases de données PubMed, Scopus et Web of Science. De plus en plus de preuves issues des données de TEP, d’IRM et de connectivité fonctionnelle révèlent des perturbations des noyaux gris centraux lors d’un épuisement dû à une longue COVID, notamment une inflammation, des perturbations métaboliques, des changements de volume et des altérations du réseau axées sur les circuits dopaminergiques striataux régulant la motivation. Les théories suggèrent que les perturbations de la signalisation induites par l’inflammation pourraient entraver l’évaluation de l’effort/récompense, perturber les voies de motivation cortico-sous-corticales ou diminuer l’apport excitateur aux centres d’éveil, atténuant ainsi l’initiation de la pulsion. Des projets pilotes thérapeutiques récents ciblant les anomalies des noyaux gris centraux montrent une efficacité provisoire. Cependant, des résultats hétérogènes, des mesures incohérentes et des écarts entre la fatigue perçue et objective tempèrent les conclusions. Malgré les recherches croissantes, des lacunes subsistent dans la compréhension des voies précises reliant le dysfonctionnement des noyaux gris centraux à la fatigue et dans la validation de l’efficacité du traitement. Des recherches supplémentaires sont nécessaires pour faire progresser la compréhension de la contribution des noyaux gris centraux aux séquelles neurologiques de longue durée du COVID et offrir l’espoir d’améliorer le fonctionnement de la population affectée en expansion.
Mots clés:
1. Introduction
Le Long-COVID est défini comme la continuation ou le développement de nouveaux symptômes 3 mois après l’infection initiale par le SRAS-CoV-2, ces symptômes durant au moins 2 mois sans autre explication [
1 ]. Les manifestations neuropsychiatriques sont fréquentes, avec une fatigue sévère signalée chez plus de 80 % des patients [
2 ,
3 ]. Cette fatigue est implacable, limite profondément le fonctionnement quotidien et manque jusqu’à présent de traitements efficaces. Comprendre les fondements de la lassitude liée au long COVID est essentiel, étant donné les projections selon lesquelles le long COVID pourrait affecter plus de 100 millions de personnes dans le monde [
4 ].Récemment, l’attention s’est tournée vers les noyaux gris centraux, un groupe interconnecté de noyaux sous-corticaux connus pour réguler la conduite veille-sommeil, la motivation, le contrôle moteur et la prise de décision basée sur l’effort [
5 ]. Composés de structures, notamment le striatum, le pallidum, la substance noire et le noyau sous-thalamique, les noyaux gris centraux reçoivent des entrées et des signaux vers de nombreuses zones corticales [
6 ] (
Figure 1 ; [
7 ]). Ce placement stratégique à l’intersection des boucles limbique, cognitive et motrice suggère que les noyaux gris centraux peuvent orchestrer divers aspects du comportement et de la physiologie liés à la fatigue.
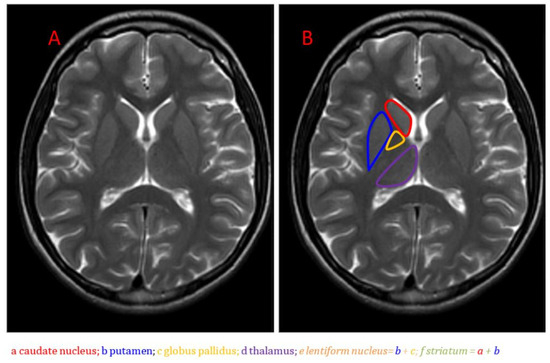
Figure 1. IRM anatomique des noyaux gris centraux dans le plan axial en imagerie pondérée T2 : (
A ) Image non marquée ; (
B ) Image avec noyau caudé, putamen, globus pallidus et thalamus étiquetés [
7 ].Notamment, de nouvelles preuves de neuroimagerie révèlent que les patients atteints d’un long COVID présentent une inflammation, un hypométabolisme et des modèles de connectivité perturbés impliquant les circuits des noyaux gris centraux [
8 ,
9 ,
10 ,
11 ]. La spécificité des changements sous-corticaux indique un dysfonctionnement de la signalisation entre les noyaux gris centraux et les réseaux interconnectés en tant que moteur des symptômes persistants. Comprendre exactement comment la pathologie des noyaux gris centraux influence les déficits d’excitation corticale et de motivation pourrait faire la lumière sur les mécanismes de fatigue post-virale. Cela peut également révéler des opportunités thérapeutiques sur mesure. Il est essentiel de clarifier le rôle des noyaux gris centraux dans le « brouillard du long COVID », compte tenu de l’ampleur de la crise du long COVID.L’objectif de cette revue narrative est de synthétiser les preuves actuelles sur le rôle des noyaux gris centraux dans la fatigue due à une longue COVID, de discuter des mécanismes potentiels et de mettre en évidence les interventions thérapeutiques prometteuses.Afin de rassembler la littérature pertinente pour cette revue narrative, une recherche approfondie a été menée à l’aide des bases de données PubMed, Scopus et Web of Science. La recherche comprenait des combinaisons de mots-clés tels que « long-COVID », « fatigue », « noyaux gris centraux », « neuroimagerie », « inflammation », « dopamine » et « traitement ». La recherche a été limitée aux articles en anglais publiés entre janvier 2020 et décembre 2023. Les listes de références des articles pertinents ont également été examinées manuellement pour rechercher des études supplémentaires. Les critères d’inclusion se sont concentrés sur les études portant sur les symptômes neurologiques, en particulier la fatigue, chez les patients atteints d’une longue COVID, en utilisant des techniques de neuroimagerie pour examiner les changements cérébraux, en explorant le rôle des noyaux gris centraux et en discutant de traitements potentiels ciblant le dysfonctionnement des noyaux gris centraux.
2. Dysfonctionnement des noyaux gris centraux en cas de fatigue due à une longue COVID : données probantes issues de la neuroimagerie
Les données émergentes issues d’études de neuroimagerie structurelle et fonctionnelle révèlent que les survivants du COVID-19 présentent des anomalies spécifiques localisées dans les réseaux de noyaux gris centraux sous-corticaux. L’inflammation, l’hypométabolisme et la perturbation de la connectivité impliquant le caudé, le putamen, le pallidum et le noyau accumbens indiquent que les noyaux gris centraux sont à l’origine de symptômes neurologiques persistants.
2.1. Preuve de dysfonctionnement métabolique
Les techniques d’IRM quantitatives permettent de déduire les signatures chimiques de l’environnement dans le cerveau. Lu et coll. [
12 ] utilisé la spectroscopie par résonance magnétique (MRS) pour découvrir des schémas métaboliques aberrants dans les régions striatales chez les patients atteints d’une infection COVID de 10 mois par rapport aux témoins. Plus précisément, une altération de la choline et du lactate suggérait une neuroinflammation continue, tandis qu’une réduction du glutamate laissait entendre une interférence possible dans la signalisation excitatrice. De plus, une baisse critique du N-acétylaspartate faisait allusion à une intégrité neuronale compromise. Ensemble, ces perturbations métaboliques centrées autour des noyaux caudés et putamen proposent que le long COVID perturbe l’homéostasie des noyaux gris centraux. Une autre étude [
13 ] qui a examiné les IRM cérébrales chez des patients atteints d’un long COVID a révélé que 56 % d’entre eux présentaient une hyperintensité des noyaux gris centraux, suggérant des lésions et une inflammation des tissus cérébraux. Ces anomalies IRM au sein des noyaux gris centraux pourraient être révélatrices d’une neuroinflammation, d’une hypoperfusion et d’autres processus pathologiques affectant les structures cérébrales profondes chez les patients présentant des effets persistants du COVID-19. Une autre étude de Kandemirli et al. [
14 ] ont également noté des hyperintensités T1 dans les noyaux gris centraux des patients atteints de COVID long. De plus, la spectroscopie par résonance magnétique (MRS) a montré une réduction des ratios N-acétylaspartate (NAA)/créatine (Cr) et NAA/choline (Cho), impliquant une perte neuronale et une diminution de la production d’énergie. Ces changements métaboliques étaient associés à des symptômes neurologiques comme des maux de tête, des vertiges et des problèmes cognitifs.D’autres études IRM démontrent une inflammation focale concentrée à l’intérieur des noyaux gris centraux chez les patients présentant des problèmes persistants comme la fatigue et les troubles cognitifs chez les patients atteints d’une longue COVID [
3 ,
10 ,
15 ]. Cette inflammation est en corrélation avec des mesures cliniques de brouillard cérébral et d’intolérance à l’effort. L’imagerie TEP montre de la même manière un hypométabolisme aberrant regroupé autour des régions striatales et pallidales [
16 ]. La signature d’imagerie partage une ressemblance avec celle observée dans les maladies auto-immunes comme le lupus et la maladie de Still et pourrait refléter une neuropathologie localisée.Une récente étude pilote FDG-PET réalisée par Luo et al. [
17 ] ont démontré que les patients fatigués et non fatigués atteints d’un long COVID présentaient un hypométabolisme du glucose réduit dans la région du globus pallidus (GP) des noyaux gris centraux par rapport aux témoins sains. Plus précisément, cela suggère que des facteurs autres que la simple fatigue influencent le dysfonctionnement des noyaux gris centraux. Le groupe non fatigué a montré un hypométabolisme GP encore plus important que le groupe fatigué. Plusieurs facteurs pourraient expliquer cette dissociation relative : les patients sans fatigue peuvent avoir une activité générale de base plus importante, qui a moins diminué par rapport aux niveaux pré-infectieux. Alternativement, une neuroinflammation GP plus sévère chez les patients non fatigués pourrait altérer la fonction par d’autres voies que la déplétion énergétique. Cela indique également des voies supplémentaires contribuant à des déficits motivationnels et cognitifs distincts de la fatigue subjective. Un effet hémisphérique a été observé avec un hypométabolisme plus important du médecin généraliste droit chez les patients, quel que soit leur état de fatigue. Cette latéralité suggère des impacts asymétriques potentiels sur le traitement de l’information entre les hémisphères des noyaux gris centraux. Les noyaux gris centraux, en particulier le médecin généraliste droit, semblent sensibles à diverses agressions liées à l’infection au COVID-19. Les raisons sous-jacentes à cette vulnérabilité régionale nécessitent une étude plus approfondie, mais l’inflammation, l’hypoxie et l’anxiété sont des possibilités. Plus important encore, le dysfonctionnement de ce circuit de motivation sous-cortical pourrait aider à expliquer la diversité des symptômes neurocognitifs auxquels de nombreux patients sont confrontés au cours d’une convalescence de longue durée.
Le tableau 1 organise de manière concise les principales conclusions liées aux modifications des noyaux gris centraux et à leurs associations avec la fatigue due à une longue COVID et d’autres symptômes persistants dans plusieurs études portant sur différentes populations de patients et périodes de suivi. Les altérations structurelles et fonctionnelles indiquent systématiquement un substrat sous-cortical pour des problèmes neurologiques persistants.
Tableau 1. Principaux résultats liés aux modifications des noyaux gris centraux et à leurs associations avec la fatigue due à une longue COVID et d’autres symptômes persistants dans plusieurs études.

2.2. Perturbations de connectivité fonctionnelle
Au-delà des changements chimiques statiques, l’IRM fonctionnelle au repos délimite les relations d’activité entre des zones cérébrales disparates. Douaud et coll. [
10 ] a cartographié la connectivité fonctionnelle chez plus de 600 individus précédemment infectés par le SRAS-CoV-2. Les participants récupérés ont démontré un affaiblissement constant de la connectivité entre les noyaux gris centraux, les thalami et les régions sensorielles primaires par rapport aux témoins. Des tendances similaires sont apparues dans une cohorte indépendante de voyageurs long-courriers, corroborant cette signature distincte de dérégulation des circuits dopaminergiques. Les auteurs suggèrent qu’une fatigue à long terme et des symptômes cognitifs et de l’humeur pourraient résulter d’une communication perturbée entre les voies dopaminergiques striatales et les entrées sensorielles en amont.Tout aussi frappantes sont les expériences fonctionnelles d’IRM et de SPECT révélant une connectivité déficiente impliquant sélectivement les voies des noyaux gris centraux [
18 ,
19 ]. La cohérence réduite au sein des réseaux nigrostriataux et corticostriataux concorde avec les plaintes de perte de motivation et de fatigue mentale. Un échec des centres de relais des noyaux gris centraux à moduler les signaux entre les entrées motivationnelles limbiques et les contrôleurs cognitifs préfrontaux peut se manifester sur le plan comportemental par un épuisement. Les traitements rétablissant la communication des noyaux gris centraux pourraient améliorer les niveaux d’énergie en réintégrant les processus d’humeur et de mouvement.De même, une autre étude IRMf réalisée par Huang et al. [
16 ] a révélé une diminution de la connectivité entre le globus pallidus et les réseaux de contrôle exécutif frontopariétal. L’étendue du découplage du globus pallidus était proportionnelle à la gravité des troubles cognitifs liés à l’inattention et aux problèmes de récupération de la mémoire. Une connectivité perturbée des noyaux gris centraux et frontopariétals contribue probablement au dysfonctionnement exécutif couramment signalé par les patients atteints d’une longue COVID. En plus des perturbations de la connectivité fonctionnelle, l’imagerie TEP moléculaire fournit des preuves d’anomalies dopaminergiques provenant des noyaux gris centraux dans les cas de COVID long.
2.3. Inadéquation dans l’architecture structurelle
Enfin, la neuroimagerie structurelle indique des réarrangements anatomiques accompagnant les anomalies fonctionnelles décrites ci-dessus. À l’aide de l’IRM multicontraste, une étude de 2022 [
10 ] a découvert des expansions de volume relatives dans les régions caudées et accumbens et une constriction au sein du globus pallidi chez les sujets COVID longs. L’élargissement des zones du striatum dorsal peut refléter une inflammation, une microgliose ou un dysfonctionnement vasogénique, tandis que l’atrophie pallidale fait allusion à une neurodégénérescence. Une telle asymétrie structurelle laisse à nouveau entendre que le long COVID peut perturber l’équilibre des noyaux des noyaux gris centraux. Les patients ont en outre démontré une surface corticale réduite et des perturbations des radiations thalamiques, qui, ensemble, soutiennent une atteinte sous-corticale. Les études sur le dysfonctionnement des noyaux gris centraux chez les patients atteints d’une longue COVID fournissent des indices sur les mécanismes neurologiques qui peuvent contribuer à la fatigue chronique, mais des recherches supplémentaires sont nécessaires pour confirmer ces liens. Une autre étude utilisant l’imagerie du tenseur de diffusion (DTI) réalisée par Zhou et al. [
20 ] a révélé une connectivité structurelle altérée entre les composants des noyaux gris centraux. Les patients présentaient une intégrité réduite de la substance blanche dans les voies nigrostriatales. Cependant, ils présentaient une connectivité structurelle accrue dans les circuits limbiques et frontopariétaux ventromédian. Cette inadéquation implique une réorganisation complexe des réseaux structurels impliquant les noyaux gris centraux dès le début de la maladie.Hafiz et coll. [
21 ] a examiné les différences de volume de matière grise (GMV) entre 46 patients en convalescence du COVID-19 et 30 témoins sains, ainsi que les corrélations entre le GMV et les niveaux de fatigue autodéclarés. Des IRM ont été réalisées 2 semaines après la sortie de l’hôpital. Le groupe COVID-19 a montré des niveaux de fatigue significativement plus élevés que les témoins. Ils ont également montré un GMV significativement plus élevé dans plusieurs régions du système limbique (par exemple, hippocampe, amygdale) et régions des noyaux gris centraux (par exemple, putamen, pallidum). Dans les deux groupes, des niveaux de fatigue plus élevés étaient positivement corrélés au GMV dans le cortex cingulaire postérieur, le précuneus et le lobe pariétal supérieur. Cependant, le groupe COVID-19 a montré des corrélations positives significativement plus fortes entre les niveaux de fatigue et le GMV dans ces régions par rapport aux témoins. Les différences de GMV s’alignent sur les résultats d’études de cas sur un seul patient montrant une implication neurologique dans une infection aiguë au COVID-19. La corrélation entre un GMV plus élevé et une fatigue accrue correspond également aux recherches existantes reliant ces régions du cerveau à la fatigue dans d’autres troubles. Les auteurs concluent que même 2 semaines après leur sortie, les patients en convalescence du COVID-19 présentent des altérations du GMV dans les régions liées aux symptômes aigus, ainsi qu’un lien plus fort entre le GMV dans les zones liées à la fatigue et les niveaux de fatigue autodéclarés. Cela peut donner un aperçu des symptômes neurologiques persistants chez les survivants du COVID-19.Heine et coll. [
22 ] a examiné les changements structurels cérébraux associés à la fatigue due à une longue COVID chez 50 patients par rapport à 47 témoins sains, ainsi que 47 patients atteints de sclérose en plaques (SEP) souffrant de fatigue. À une médiane de 7,5 mois après une forme aiguë de COVID-19, 47 patients ont présenté une fatigue modérée à sévère. Ces patients atteints d’une longue COVID présentaient également des niveaux plus élevés d’anxiété, de dépression, de somnolence diurne et de problèmes de sommeil par rapport aux témoins. Les analyses IRM ont révélé des changements structurels dans le thalamus et les noyaux gris centraux des patients atteints de COVID long, notamment une perte de volume, des déformations de surface et des paramètres de diffusion modifiés. Ces changements sous-corticaux étaient corrélés à la gravité de la fatigue et aux déficiences quotidiennes. Les patients atteints de COVID long ont présenté des modifications sous-corticales qui se chevauchent mais moins étendues que les patients atteints de SEP. Dans la SEP, les changements étaient davantage liés à la charge lésionnelle globale qu’à la fatigue. La gravité de la fatigue due à une longue COVID était associée à la qualité du sommeil et à la dépression, mais pas à la gravité ou à la durée aiguë de la COVID-19. Les auteurs concluent que la fatigue persistante dans le syndrome de la COVID-19 longue a un substrat structurel distinct axé sur le thalamus et les noyaux gris centraux. Cela donne un aperçu de l’impact neurologique du long COVID. En résumé, cette étude démontre des changements structurels cérébraux liés à la fatigue à long terme due au COVID, axés sur les régions sous-corticales qui s’alignent sur les changements liés à la fatigue observés dans d’autres troubles comme la SEP.Enfin, Deters et al. [
23 ] ont exploré les modifications du volume cérébral et du métabolisme du glucose chez 33 personnes ayant déjà eu un COVID-19 léger, divisées en un groupe post-infection <6 mois (n = 18) et un groupe post-infection > 6 mois (n = 15). ). Le groupe de plus de 6 mois a présenté des volumes plus petits dans le putamen, le pallidum et le thalamus par rapport au groupe de moins de 6 mois. Les sujets fatigués du groupe âgé de plus de 6 mois présentaient également des volumes de lobe frontal plus petits que les sujets non fatigués. Une fatigue plus intense et une fatigabilité perçue étaient associées à des volumes de lobe frontal plus petits dans le groupe âgé de plus de 6 mois. Il n’y avait aucune différence dans le métabolisme cérébral du glucose entre les groupes de moins de 6 mois et de plus de 6 mois. Cependant, les deux groupes ont montré un hypo- et un hypermétabolisme dans certaines régions par rapport à une base de données normative saine. Les résultats suggèrent qu’un COVID-19 léger peut entraîner une diminution retardée des volumes des lobes sous-corticaux et frontaux, en particulier chez les personnes souffrant de fatigue persistante (
Figure 2 ; [
23 ]). Les mécanismes ne sont pas clairs mais pourraient impliquer des circuits noyaux gris centraux-corticaux sous-jacents à la motivation et au contrôle moteur.
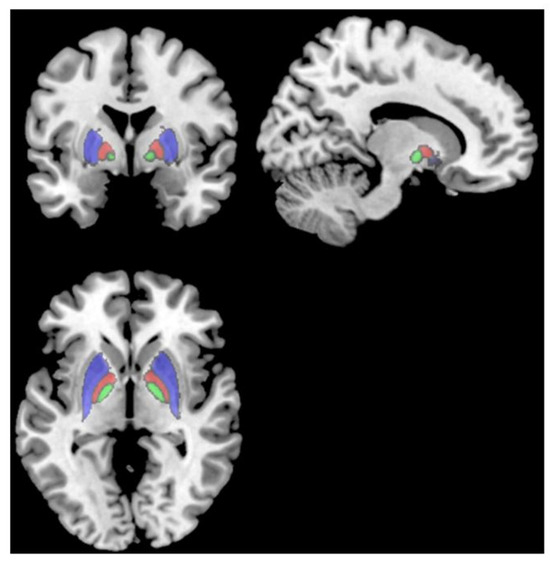
Figure 2. IRM T1 montrant le putamen (rouge), le pallidum (cyan) et le thalamus (vert), qui avaient tous des volumes plus petits chez les sujets > 6 mois après l’infection que chez les sujets < 6 mois après l’infection [
23 ].Les analyses IRM et DTI démontrent des changements anormaux dans l’architecture des noyaux gris centraux au cours de la première phase de récupération après une longue COVID. L’inadéquation entre les différentes voies de connectivité laisse entrevoir un processus de recâblage inadapté. Une exploration plus approfondie de la façon dont ces lésions progressent au fil du temps et sont en corrélation avec les symptômes pourrait faire la lumière sur les mécanismes des séquelles neurologiques à long terme et éclairer les interventions.Alors que les enquêteurs continuent d’élaborer sur les fondements de l’impact neurologique du long COVID, de plus en plus de preuves en neuroimagerie convergent vers la dérégulation des noyaux gris centraux en tant que substrat candidat perpétuant la fatigue et le dysfonctionnement cognitif. À l’avenir, la caractérisation longitudinale des changements métaboliques, fonctionnels et structurels au sein des circuits cortico-noyaux de la base est prometteuse pour le développement de biomarqueurs diagnostiques et de cibles thérapeutiques rationnelles pour les symptômes lourds à long terme.
3. Théories sur les mécanismes causatifs
Il existe trois théories interdépendantes prédominantes décrivant les voies potentielles menant des anomalies observées des noyaux gris centraux à la fatigue extrême qui afflige les survivants de la longue COVID.
3.1. Dysfonctionnement de la signalisation de la dopamine induit par l’inflammation
Les noyaux gris centraux dépendent de manière essentielle de la neurotransmission de la dopamine pour stimuler la motivation et la génération d’efforts [
24 ,
25 ,
26 ]. Les signaux dopaminergiques se projettent de la substance noire vers les régions striatales dorsale et ventrale, modulant l’excitabilité neuronale. Ces projections dopaminergiques et leurs cibles jouent un rôle central dans le codage des erreurs de prédiction des récompenses et de l’importance des incitations – en jugeant les besoins d’effort par rapport aux récompenses probables pour guider la prise de décision coût/bénéfice sous-jacente au comportement motivé [
27 ,
28 ,
29 ,
30 ]. Des études TEP émergentes révèlent que la neuroinflammation à long COVID se localise dans plusieurs noyaux de noyaux gris centraux, y compris les sites de projection de dopamine de la substance noire, ainsi que dans le putamen et les régions caudées récepteurs de dopamine [
10 ]. Une activation microgliale localisée pourrait provoquer des déséquilibres excitotoxiques dans la disponibilité ou la dynamique de libération de la dopamine. Les modèles animaux démontrent que l’inflammation de la substance noire perturbe la transmission nigrostriatale de la dopamine par des dommages oxydatifs [
20 ]. L’exposition aux cytokines régule négativement le transport actif de la tyrosine hydroxylase et de la dopamine en culture [
30 ]. Des mécanismes similaires dans les circuits des noyaux gris centraux à long COVID pourraient fausser l’évaluation de la récompense et le calcul de l’effort médié par le striatum [
27 ,
28 ,
29 ]. Les signaux dopaminergiques ne parvenant pas à traduire avec précision le plaisir attendu en motivation à l’action, l’activation comportementale peut faiblir. Plutôt que de manifester des déficits moteurs manifestes, une érosion plus subtile de la volonté de faire des efforts lorsque les récompenses semblent insuffisantes pourrait se manifester par de la fatigue. Cette cascade proposée liant les modifications inflammatoires des noyaux gris centraux au dysfonctionnement de la dopamine et aux troubles de la motivation mérite une exploration plus approfondie en tant que mécanisme candidat sous-jacent à l’épuisement dû à une longue COVID. Clarifier les contributions de la neuroinflammation par rapport à l’excitotoxicité ou aux modifications du transport dans la dérégulation de la dopamine pourrait guider le développement thérapeutique.
3.2. Perturbation des voies motivationnelles corticales-striatales
Les noyaux gris centraux sont stratégiquement situés à l’intersection des boucles limbiques, cognitives et motrices pour intégrer la motivation à l’action [
31 ]. Les projections dopaminergiques de la zone tegmentale ventrale et de la substance noire fournissent des signaux de valeur et de saillance aux zones striatales qui reçoivent également des informations contextuelles de l’hippocampe, de l’amygdale et du cortex préfrontal [
32 ]. Le striatum traite ces divers flux pour estimer les efforts requis et les récompenses probables, façonnant ainsi une impression de valeur d’action potentielle. Les nœuds Globus pallidus et substantia nigra reticulata envoient des informations intégrées sur la motivation et la planification des mouvements au cortex moteur directement et via des circuits thalamocorticaux [
31 ]. La sortie résultante vers les zones préfrontales dorsolatérales ferme la boucle, reliant les valeurs d’action à des décisions d’ordre supérieur concernant l’activation comportementale [
33 ]. Si une inflammation ou des altérations structurelles perturbent la communication entre les principaux ganglions de la base, ce calcul complexe risque/bénéfice pourrait devenir parasité ou biaisé. L’impression de toutes les actions potentielles nécessitant des efforts inacceptables pour des récompenses dérisoires se manifeste psychologiquement par de la fatigue ou une perte de motivation [
34 ]. La régulation positive inadaptée de la signalisation TGF-bêta présente un mécanisme candidat par lequel la réorganisation cytoarchitecturale entre le striatum, le pallidum et la substance noire pourrait repondérer les voies cortico-striatales à partir de comportements d’effort [
35 ,
36 ]. Vérifier si les agents anti-inflammatoires préviennent de tels déficits de motivation au niveau du réseau pourrait clarifier les contributions à la fatigue liée au long COVID.
3.3. Perte de l’apport des noyaux gris centraux excitateurs aux centres d’éveil
En plus de guider la motivation, les noyaux gris centraux jouent également un rôle essentiel dans la modulation des transitions veille-sommeil et dans l’allocation de ressources attentionnelles aux tâches nécessitant un effort cognitif [
37 ,
38 ]. Dans le cadre de la régulation de l’éveil et de l’attention, les projections excitatrices s’étendent de la substance noire, du pallidum ventral et de l’aire tegmentale ventrale jusqu’à divers nœuds du système d’éveil ascendant. Ceux-ci incluent les noyaux thalamiques intralaminaires et médians avec des projections corticales diffuses, ainsi que les noyaux du tronc cérébral activant les systèmes histaminergiques, noradrénergiques, sérotoninergiques, orexinergiques et cholinergiques [
37 ]. Grâce à ces voies, les noyaux gris centraux fournissent une mesure de stimulation qui sert à stabiliser la cognition et la vigilance. Les études TEP indiquent une neuroinflammation à long COVID dans les structures des noyaux gris centraux contribuant à la régulation de l’éveil, y compris la substance noire [
10 ]. Les modèles animaux démontrent également la perte sélective des neurones dopaminergiques striataux suite à une infection [
39 ]. L’atténuation qui en résulte des sorties excitatrices vers les cibles thalamiques et du tronc cérébral pourrait altérer la capacité à maintenir l’attention et l’éveil axés sur la tâche. Les noyaux gris centraux ne fournissant plus d’apports stimulants adéquats pour contrer la pression homéostatique du sommeil, des symptômes ressemblant à un épuisement chronique ou à un brouillard mental apparaissent [
38 ].Vérifier si l’inflammation des noyaux gris centraux prédit des déficits d’éveil ultérieurs chez les personnes atteintes d’un long COVID pourrait clarifier le rôle de ce mécanisme proposé dans leur fatigue. Les agents sélectifs améliorant l’excitation pourraient également soulager les symptômes en compensant l’épuisement des signaux excitateurs.
4. Symptômes liés à la fatigue et dysfonctionnement des noyaux gris centraux
Les mesures de réponse à la pandémie telles que la quarantaine et l’isolement social, bien qu’efficaces pour ralentir la propagation du virus, peuvent involontairement aggraver la fatigue des patients atteints du COVID-19 en augmentant les problèmes de santé comme le stress post-traumatique, l’anxiété, la dépression et la douleur. On pense que ces conséquences psychologiques négatives contribuent de manière significative aux niveaux de fatigue [
40 ].Des études estiment que 67 à 80 % des transporteurs long-courriers signalent une fatigue, dépassant celle des témoins même 12 mois après l’infection [
41 ,
42 ,
43 ]. Ces patients souffrent fréquemment de stress, d’anxiété, de dépression et de douleurs généralisées. Par exemple, plus de la moitié des personnes atteintes d’un long COVID présentent des niveaux cliniques d’anxiété et de dépression [
3 ]. Les symptômes de la douleur affectent également plus de la moitié des patients, notamment des maux de tête, des douleurs nerveuses, des douleurs musculaires, des douleurs articulaires et des douleurs thoraciques [
44 ]. Les chercheurs proposent que la fatigue et la douleur dues à un long COVID puissent être provoquées par des facteurs inflammatoires déclenchant une sensibilisation centrale [
45 ,
46 ]. La détresse psychologique chez les longs courriers est significativement corrélée à une plus grande fatigue, un sommeil de moins bonne qualité et une qualité de vie réduite, démontrant l’interconnectivité [
47 ]. À mesure que des symptômes persistants comme la fatigue s’accumulent, ils peuvent déclencher du stress et des problèmes d’humeur. Les approches multimodales abordant l’inflammation, les voies neuronales, la santé mentale et la douleur de manière holistique peuvent améliorer la fatigue et les symptômes associés en cas de longue COVID.De nouvelles preuves suggèrent que le dysfonctionnement des noyaux gris centraux peut contribuer aux symptômes persistants liés à la fatigue chez les patients atteints d’une longue COVID. Les noyaux gris centraux jouent un rôle important dans la génération d’efforts et la motivation, qui sont altérées chez de nombreuses personnes souffrant d’une fatigue intense. Les chercheurs ont découvert une accumulation de sous-produits métaboliques toxiques dans les noyaux gris centraux des patients atteints de COVID long, ce qui est en corrélation avec une motivation réduite et une diminution de l’activation volontaire mesurée par IRM [
48 ]. Un dysfonctionnement des circuits de communication des noyaux gris centraux pourrait diminuer la motivation à s’engager dans des activités nécessitant un effort soutenu. Une altération de la motivation et de la génération d’efforts induite par la pathologie des noyaux gris centraux pourrait également perpétuer d’autres symptômes liés comme la dépression, l’anxiété et la douleur chez les longs courriers en réduisant l’engagement dans des comportements productifs. Les perturbations entre les noyaux gris centraux, le cortex cingulaire antérieur et l’insula peuvent aggraver davantage les symptômes de fatigue et de douleur en cas de COVID long [
47 ]. L’évaluation et le ciblage du dysfonctionnement des noyaux gris centraux au moyen d’interventions motivationnelles ou de techniques neuromodulatoires pourraient apporter des avantages thérapeutiques contre la fatigue, la douleur, le stress et les troubles de l’humeur liés aux séquelles à long terme du COVID.Il est frappant de constater que le profil multisystémique complexe du long COVID présente une ressemblance remarquable avec plusieurs maladies chroniques établies pour lesquelles une fatigue intense est également une caractéristique. Ceux-ci incluent des syndromes post-viraux comme l’encéphalomyélite myalgique/syndrome de fatigue chronique (EM/CFS), ainsi que la fibromyalgie, la maladie de la guerre du Golfe et la sclérose en plaques (SEP) [
48 ]. Parmi ces troubles, les connaissances émergentes mettent en évidence des mécanismes pathologiques sous-jacents communs qui pourraient favoriser des trajectoires comparables de maladies liées à la fatigue. Par exemple, il a été démontré que l’anxiété et la dépression prédisent la gravité de la fatigue dans les populations atteintes de maladies chroniques [
49 ,
50 ]. À l’inverse, la fatigue peut exacerber la détresse émotionnelle et les niveaux de stress perçus [
51 ,
52 ]. L’intensité de la douleur et les niveaux de fatigue s’influencent également mutuellement, une douleur plus importante prédisant une fatigue accrue et une fatigue plus grande amplifiant les symptômes de la douleur [
53 ,
54 ]. Les chercheurs ont proposé des voies biologiques sous-jacentes communes, notamment la dérégulation de l’axe hypothalamo-hypophyso-surrénalien (HPA), l’inflammation, le stress oxydatif et la sensibilisation du système nerveux central en tant que moteurs de ce groupe de symptômes [
50 ,
55 ].En plus des preuves sur les mécanismes communs de fatigue persistante, de nouvelles recherches suggèrent également que le dysfonctionnement des noyaux gris centraux pourrait être à l’origine de déficits de motivation et d’intolérance à l’effort, traversant de nombreux troubles. Les noyaux gris centraux jouent un rôle essentiel dans la génération d’efforts, le traitement des récompenses et le contrôle moteur. Dans les blessures ou les maladies déclenchant une fatigue chronique comme le TBI, la maladie de Parkinson et les syndromes post-viraux, la neuroimagerie révèle une activation supprimée des structures des noyaux gris centraux lors de tâches exigeant des efforts [
56 ]. Les chercheurs proposent que le dysfonctionnement de la signalisation nigrostriatale de la dopamine réduit la motivation à adopter des comportements nécessitant un effort soutenu, précipitant une fatigue généralisée et un retrait psychosocial associé. Des modèles similaires de dopamine striatale émoussée sont observés dans les cas de COVID long, en corrélation avec l’intolérance à l’effort et la fatigue signalées par les patients [
12 ]. Comme dans d’autres conditions de fatigue comme l’EM/CFS, une communication aberrante des noyaux gris centraux pourrait diminuer la volonté de déployer l’effort requis pour les activités quotidiennes typiques des transporteurs long-courriers. Les traitements ciblant une disponibilité accrue de dopamine peuvent soulager l’épuisement lié à l’effort. Une interrogation plus approfondie sur la pathologie des noyaux gris centraux fournit un autre point de convergence translationnelle dans les paysages de fatigue chronique.Les traitements ciblant ces mécanismes peuvent être efficaces pour traiter les multiples symptômes corrélés. Compte tenu des relations entre la fatigue, le stress, les troubles de l’humeur et la douleur, l’évaluation de ces symptômes doit être coordonnée et la prise en charge doit adopter une approche holistique.
5. Opportunités thérapeutiques
À mesure que les preuves cristallisant les contributions des noyaux gris centraux au long COVID s’accumulaient, les chercheurs ont piloté des traitements visant à traiter les anomalies sous-corticales à l’origine de la fatigue, notamment les suivantes.Agents anti-inflammatoires. Les médicaments immunomodulateurs comme les perfusions de colchicine et d’immunoglobulines intraveineuses (IVIG) pourraient soulager la neuroinflammation localisée centrée sur les noyaux gris centraux documentée dans les études d’imagerie [
57 ]. Dans une étude ouverte, 14 patients atteints de COVID long recevant 1 mois d’IgIV ont connu des améliorations marquées et soutenues de la fatigue à mesure que l’inflammation se résolvait sur les TEP [
58 ]. Des preuves plus rigoureuses proviennent d’un essai randomisé de 3 mois révélant que la colchicine atténuait à la fois le dysfonctionnement cognitif et la fatigue par rapport au placebo [
57 ]. En tant qu’inhibiteur des microtubules utilisé pour traiter la goutte, la colchicine possède des propriétés anti-inflammatoires qui semblent bénéfiques en cas de COVID long. Plus précisément, en supprimant l’activation microgliale et la libération concomitante de cytokines, comme l’IL-1β, le TNF-α et l’oxyde nitrique, la colchicine peut interrompre les cycles d’auto-amplification de lésions dopaminergiques à médiation immunitaire centrées sur les noyaux gris centraux [
59 ,
60 ]. Les chercheurs postulent que les réductions ultérieures de l’élagage microglial aberrant permettent la récupération des voies perturbées de motivation/récompense et de contrôle moteur [
60 ].Des questions ouvertes demeurent concernant les agents optimaux, le moment et la durée de l’immunomodulation en cas de fatigue prolongée due au COVID et de symptômes cognitifs. Néanmoins, les premiers succès donnent matière à un optimisme prudent. Cibler la neuroinflammation et ses impacts secondaires sur les structures sous-corticales pourrait atténuer l’intolérance à l’activité qui est si invalidante pour les longs courriers qui s’efforcent de reconstruire leur vie après la COVID.Thérapies dopaminergiques. Des stratégies améliorant la signalisation de la dopamine via des précurseurs de la dopamine ou des agonistes des récepteurs D2/D3 pourraient contrecarrer les déficits dans les circuits de motivation striatale [
61 ,
62 ]. En amplifiant la conversion de l’impulsion décisionnelle en action, les traitements dopaminergiques pourraient éventuellement dynamiser l’initiation. Néanmoins, les schémas posologiques optimaux restent incertains, étant donné la possible régulation négative des récepteurs de la dopamine en cas d’exposition chronique aux stimulants [
63 ]. Des recherches supplémentaires devraient explorer des approches combinées, comme l’association d’immunomodulateurs qui résolvent la neuroinflammation avec des agents dopaminergiques qui redémarrent les circuits de récompense intrinsèques endommagés secondairement. Les premiers succès justifient l’optimisme quant au fait que les stratégies pharmacologiques ciblant la carence en dopamine qui sous-tend la fatigue due à une longue COVID peuvent aider les patients à reprendre leur vie en main. Néanmoins, nous devons utiliser ces traitements judicieusement jusqu’à ce que des essais plus larges clarifient les options de substances idéales, les durées et les profils de risque.Neurostimulation. La stimulation non invasive utilisant des impulsions électromagnétiques ou ultrasoniques pour éteindre les foyers d’inflammation dans les noyaux gris centraux est prometteuse pour les longs COVID [
64 ]. De même, des modalités telles que le tDCS visant à recalibrer la connectivité cortico-striatale via une modulation électrique pourraient rééquilibrer les voies, en maintenant un engagement sans effort [
65 ].Noda et coll. [
66 ] a démontré que la stimulation magnétique transcrânienne répétitive (rTMS) peut améliorer considérablement la fatigue et le dysfonctionnement cognitif dans les cas de COVID long lorsqu’elle est appliquée au cortex préfrontal dorsolatéral gauche (DLPFC) en 20 séances quotidiennes [
4 ]. Les chercheurs postulent que la stimulation des régions sous-corticales connectées peut aider à rééquilibrer la neurotransmission perturbée entre les noyaux endommagés par l’inflammation.D’autres groupes ont piloté des électrodes implantables ciblant les structures des noyaux gris centraux, constatant des améliorations marquées de la fatigue suite à une stimulation cérébrale profonde à haute fréquence du noyau accumbens chez cinq longs courriers [
67 ]. Bien qu’il s’agisse d’un dernier recours invasif, les succès préliminaires suggèrent qu’une telle neuromodulation pourrait aider à relancer les syndromes de carence en dopamine en cas d’échec des médicaments et des conseils [
68 ].De toute évidence, des recherches supplémentaires devraient optimiser les paramètres de stimulation et la sélection des patients, compte tenu de la variabilité des manifestations neurologiques des longs COVID. Cependant, les premières découvertes laissent espérer qu’une modification directe de l’activité des circuits cérébraux liés à la fatigue pourrait aider les longs transporteurs à reprendre leur vie en main.Approches multimodales. Des combinaisons intégrant des médicaments anti-inflammatoires et pro-dopaminergiques et une neurostimulation guidée par le connectome sont probablement nécessaires pour restaurer de manière holistique la forme et la fonction des noyaux gris centraux [
15 ]. Cette stratégie « d’optimisation du réseau » tient compte de l’interdépendance de la structure, de la neurochimie et du flux de communication.
6. Les défis de la recherche sur la fatigue due à une longue COVID
Il convient de noter que la recherche sur la fatigue liée à la longue COVID est confrontée à plusieurs défis critiques qui ont limité les progrès dans la compréhension de ses mécanismes, le développement de biomarqueurs et la progression de traitements efficaces. Définir et quantifier objectivement la fatigue elle-même pose des obstacles. En tant que sensation subjective et multiforme reposant fortement sur l’auto-évaluation, la fatigue échappe à une caractérisation précise [
69 ]. Les outils de mesure restent également incohérents, avec peu de consensus sur les échelles optimales malgré des options telles que l’échelle de gravité de la fatigue et l’échelle de fatigue Chalder à 11 éléments. La détermination de l’étiologie derrière l’épuisement persistant complique encore les enquêtes sur les longues périodes de COVID. On ne sait pas si la fatigue découle directement des impacts biologiques de l’infection par le SRAS-CoV-2 ou est davantage liée à des facteurs psychosomatiques et aux croyances des patients concernant le fait d’avoir eu le COVID-19 [
69 ]. De plus, une fatigabilité objective comparable entre les patients COVID longs avec et sans fatigue suggère des écarts entre les manifestations perçues et mesurables [
70 ]. Des associations aussi complexes entre la psychologie, la physiologie et la performance obscurcissent les attributions causales. Faire la différence entre les aspects perçus et objectifs de la fatigue, développer des outils de mesure spécifiques et élucider les contributeurs psychosomatiques potentiels et les corrélats neuronaux pourraient faire progresser la recherche vers des avancées thérapeutiques indispensables.Les méthodes émergentes d’intelligence artificielle (IA), y compris l’apprentissage automatique et l’apprentissage profond, sont prometteuses pour consolider les données multi-omiques personnalisées, le comportement et les signaux neuronaux pour faire progresser la recherche sur la fatigue [
71 ]. Ces techniques pourraient aider à intégrer des profils couvrant la génétique, les marqueurs moléculaires, les auto-évaluations, la neuroimagerie et l’exécution des tâches pour caractériser l’hétérogénéité de la façon dont la fatigue se manifeste d’une personne à l’autre. En appliquant de manière créative l’analyse prédictive et l’exploration de données à ces ensembles de données multiformes, les chercheurs peuvent surmonter les obstacles de longue date liés à la capture de la variabilité individuelle des expériences de fatigue. De plus, l’apprentissage automatique propose des approches permettant d’obtenir des informations à partir d’indicateurs complexes sans s’appuyer uniquement sur des procédures de mesure invasives. Les progrès reposeront sur une communication efficace et des partenariats interdisciplinaires pour compiler des ressources de données consolidées robustes qui exploitent pleinement ces capacités polyvalentes de l’IA pour la reconnaissance des formes dans la complexité biologique de la fatigue [
71 ].
7. Conclusions et orientations futures
Alors que la neuroinflammation est un phénomène connu suite à des maladies virales et systémiques, cette revue narrative apporte un nouvel éclairage sur l’impact spécifique du long COVID sur les noyaux gris centraux et ses conséquences uniques. La revue met en évidence le modèle distinctif de neuroinflammation, de perturbations métaboliques et d’altérations structurelles au sein des noyaux gris centraux qui distingue le long COVID des autres syndromes post-viraux. La localisation de ces changements dans les circuits dopaminergiques striataux et leur association avec des déficits de motivation et la gravité de la fatigue suggèrent un nouveau mécanisme physiopathologique sous-jacent aux effets neurologiques persistants du COVID long.De plus, la revue met l’accent sur le rôle potentiel des noyaux gris centraux dans l’intégration de divers aspects de la symptomatologie des longs COVID, notamment les troubles cognitifs, les troubles émotionnels et les problèmes de contrôle moteur. Cette implication multiforme des noyaux gris centraux dans le long-COVID est une caractéristique unique qui le distingue des autres maladies virales, qui peuvent avoir des impacts neurologiques plus limités ou diffus.Un autre aspect nouveau de cette revue est la discussion sur les interventions thérapeutiques émergentes ciblant les noyaux gris centraux, telles que les agents anti-inflammatoires, les médicaments dopaminergiques et les techniques de neuromodulation. Ces approches ciblées, éclairées par les anomalies spécifiques des noyaux gris centraux observées dans les cas de COVID long, représentent une voie prometteuse pour gérer les séquelles neurologiques persistantes de cette maladie.Cependant, la revue met également en évidence des lacunes importantes dans la compréhension des mécanismes précis liant le dysfonctionnement des noyaux gris centraux à la fatigue due à une longue COVID, en établissant la causalité et en validant l’efficacité du traitement. Ces lacunes soulignent la nécessité de poursuivre les recherches pour élucider les voies uniques par lesquelles le long COVID affecte les noyaux gris centraux et pour développer des interventions ciblées capables d’atténuer efficacement ses conséquences neurologiques.En conclusion, cette revue narrative fournit de nouvelles informations sur l’impact distinctif du long COVID sur les noyaux gris centraux, ses conséquences multiformes et les cibles thérapeutiques potentielles. Alors que la neuroinflammation est une caractéristique commune à de nombreuses maladies virales et systémiques, le modèle spécifique d’implication des noyaux gris centraux dans les cas de COVID long la distingue et souligne la nécessité d’interventions adaptées. Faire progresser notre compréhension de ces facteurs sous-corticaux uniques pourrait profondément améliorer la qualité de vie de la population croissante touchée par les séquelles neurologiques d’une longue COVID dans les années à venir.
Financement
Cette recherche n’a reçu aucun financement externe.
Les conflits d’intérêts
L’auteur ne déclare aucun conflit d’intérêts.
Les références
- Organisation Mondiale de la Santé. Une définition de cas clinique de l’état post-COVID-19 par un consensus Delphi. Organisation Mondiale de la Santé. 2021. Disponible en ligne : https://www.who.int/publications/i/item/WHO-2019-nCoV-Post_COVID-19_condition-Clinical_case_definition-2021.1 (consulté le 6 octobre 2021).
- Sudré, CH; Murray, B. ; Varsavsky, T. ; Graham, MS ; Penfold, RS; Bowyer, RC; Pujol, JC; Klaser, K. ; Antonelli, M. ; Canas, LS ; et coll. Attributs et prédicteurs du long COVID. Nat. Méd. 2021 , 27 , 626-631. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Taquet, M. ; Geddes, JR ; Husain, M. ; Luciano, S. ; Harrison, PJ Résultats neurologiques et psychiatriques à 6 mois chez 236 379 survivants du COVID-19 : une étude de cohorte rétrospective utilisant les dossiers de santé électroniques. Lancet Psychiatrie 2021 , 8 , 416-427. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Tenforde, MW ; Kim, SS ; Lindsell, CJ; Rose, EB; Shapiro, NI ; Fichiers, DC ; Gibbs, KW ; Erickson, HL; Steinrub, JS; Smithline, HA; et coll. Durée des symptômes et facteurs de risque de retour retardé à l’état de santé habituel chez les patients ambulatoires atteints de COVID-19 dans un réseau de systèmes de santé multiétatiques – États-Unis, mars-juin 2020. Morb. Mortel. Chaque semaine. Rep.2020 , 69 , 993-998. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Ahmad, O. ; Chan, M. ; Charron, C. ; Chakravarty, MM Dysfonctionnement des noyaux gris centraux dans le cas d’un long COVID : une étude d’association transversale. Lancet 2021 , 6 , 100134. [ Google Scholar ]
- Graham, EL; Clark, JR ; Orban, ZS ; Lim, PH; Szymanski, AL; Taylor, C. ; DiBiase, RM; Tong Jia, D. ; Balabanov, R. ; Koralnik, IJ; et coll. Symptômes neurologiques persistants et dysfonctionnement cognitif chez les « long-courriers » COVID-19 non hospitalisés. Anne. Clin. Trad. Neurol. 2021 , 8 , 1073-1085. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Paprocka, J. ; Machnikowska-Sokołowska, M. ; Gruszczyńska, K. ; Emich-Widera, E. Neuroimagerie des noyaux gris centraux dans les maladies neurométaboliques chez les enfants. Science du cerveau. 2020 , 10 , 849. [ Google Scholar ] [ CrossRef ]
- Huang, Y. ; Tan, C. ; Wu, J. ; Chen, M. ; Wang, Z. ; Luo, L. ; Zhou, X. ; Liu, X. ; Huang, X. ; Yuan, S. ; et coll. Impact de la maladie à coronavirus 2019 sur la fonction pulmonaire en début de phase de convalescence. Respirer. Rés. 2021 , 22 , 163. [ Google Scholar ]
- Ferrucci, R. ; Cuffaro, L. ; Capozza, A. ; Rosci, C. ; Maiorana, N. ; Groppo, E. ; Reitano, M. ; Poletti, B. ; Ticozzi, N. ; Tagliabue, L. ; et coll. Tomographie par émission de positons cérébrales (TEP) et anomalies cognitives un an après le COVID-19. J. Neurol. 2023 , 270 , 1823-1834. [ Google Scholar ] [ CrossRef ]
- Douaud, G. ; Lee, S. ; Alfaro-Almagro, F. ; Arthofer, C. ; Wang, C. ; McCarthy, P. ; Lange, F. ; Andersson, J. ; Griffanti, L. ; Smith, SM; et coll. Imagerie cérébrale avant et après COVID-19 dans la biobanque britannique. Nature 2022 , 604 , 697-707. [ Google Scholar ] [ CrossRef ]
- Hannanu, FF; Clément, J. ; Morelot-Panzini, C. Déficience métabolique cérébrale chez les patients présentant des symptômes persistants suite à une infection par le SRAS-CoV-2 : Une étude [18F]FDG-PET. EUR. J. Nucl. Méd. Mol. Imagerie 2022 , 49 , 588-600. [ Google Scholar ]
- Lu, Y. ; Li, X. ; Geng, D. ; Mei, N. ; Wu, PY; Huang, CC; Jia, T. ; Zhao, Y. ; Wang, D. ; Xiao, A. ; et coll. Modifications microstructurelles cérébrales chez les patients atteints de COVID-19 : étude de suivi de 3 mois basée sur l’IRM. eClinicalMedicine 2020 , 25 , 100484. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Helms, J. ; Kremer, S. ; Merdji, H. ; Cléré-Jehl, R. ; Schenck, M. ; Kummerlen, C. ; Collange, O. ; Boulay, C. ; Fafi-Kremer, S. ; Méziani, F. ; et coll. Caractéristiques neurologiques de l’infection sévère par le SRAS-CoV-2. N. Engl. J.Méd. 2021 , 382 , 2268-2270. [ Google Scholar ] [ CrossRef ]
- Kandemirli, SG; Dogan, L. ; Sarikaya, ZT ; Kara, S. ; Akinci, C. ; Kaya, D. ; Kaya, Y. ; Yildirim, D. ; Tuzuner, F. ; Yildirim, MS ; et coll. Résultats de l’IRM cérébrale chez des patients de l’unité de soins intensifs infectés par le COVID-19. Radiologie 2020 , 297 , E232–E235. [ Google Scholar ]
- Varatharaj, A. ; Thomas, N. ; Ellul, MA; Davies NW, S. ; Pollak, TA; Tenorio, EL; Sultan, M. ; Easton, A. ; Breen, G. ; Zandi, M. ; et coll. Complications neurologiques et neuropsychiatriques du COVID-19 chez 153 patients : une étude de surveillance à l’échelle du Royaume-Uni. Lancet Psychiatrie 2020 , 7 , 875-882. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Huang, Y. ; Ling, Q. ; Manyande, A. ; Wu, D. ; Xiang, B. Modifications de l’imagerie cérébrale chez les patients récupérés du COVID-19 : une revue narrative. Devant. Neurosci. 2022 , 16 , 855868. [ Google Scholar ] [ CrossRef ]
- Luo, Y. ; Gander, P. ; Wang, Y. ; Ponto, L. ; Rudroff, T. Les patients atteints de Long-COVID-19 ont présenté une diminution de l’activité du globus pallidus indépendamment de l’état de fatigue – Une étude exploratoire FDG-PET. Dans Actes de la réunion annuelle de la Society for Neuroscience, Washington, DC, États-Unis, 11-15 novembre 2023. [ Google Scholar ]
- Hampshire, A. ; Tendance, W. ; Chamberlain, SR ; Jolly, AE ; Grant, JE; Patrick, F. ; Mazibuko, N. ; Williams, Caroline du Sud ; Barnby, JM; Hellyer, P. ; et coll. Déficits cognitifs chez les personnes qui se sont remises du COVID-19. eClinicalMedicine 2021 , 39 , 101044. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Meinhardt, J. ; Radke, J. ; Dittmayer, C. ; Franz, J. ; Thomas, C. ; Mothes, R. ; Laue, M. ; Schneider, J. ; Brünink, S. ; Greuel, S. ; et coll. Invasion olfactive transmuqueuse du SRAS-CoV-2 comme porte d’entrée dans le système nerveux central chez les personnes atteintes de COVID-19. Nat. Neurosci. 2021 , 24 , 168-175. [ Google Scholar ] [ CrossRef ]
- Zhou, F. ; Tao, M. ; Shang, L. ; Liu, Y. ; Poêle, G. ; Jin, Y. ; Wang, L. ; Hu, S. ; Li, J. ; Zhang, M. ; et coll. Bilan des séquelles du COVID-19 près d’un an après le diagnostic. Devant. Méd. 2021 , 8 , 717194. [ Google Scholar ] [ CrossRef ]
- Hafiz, R. ; Gandhi, savoirs traditionnels ; Mishra, S. ; Prasad, A. ; Mahajan, V. ; Di, X. ; Nathanson, BH ; Biswal, BB Volumes plus élevés de ganglions limbiques et basaux chez les patients survivants négatifs au COVID et relations avec la fatigue. Neuroimage Rep. 2022 , 2 , 100095. [ Google Scholar ] [ CrossRef ]
- Heine, J. ; Schwichtenberg, K. ; Hartung, TJ; Rekers, S. ; Chien, C. ; Boesl, F. ; Rouille, R. ; Hohenfeld, C. ; Bungenberg, J. ; Finke, C. ; et coll. Modifications structurelles du cerveau chez les patients souffrant de fatigue due à une longue COVID : une étude observationnelle prospective. eClinicalMedicine 2023 , 58 , 101874. [ Google Scholar ] [ CrossRef ]
- Déterre, JR ; Vélosam, AC ; Gander, Î.-P.-É. ; Boles Ponto, LL; Rudroff, T. Effet du Long-COVID-19 sur le volume cérébral et le métabolisme du glucose : influence du temps écoulé depuis l’infection et de l’état de fatigue. Science du cerveau. 2023 , 13 , 675. [ Google Scholar ] [ CrossRef ]
- Trifilieff, P. ; Feng, B. ; Urizar, E. ; Winiger, V. ; Quartier, RD ; Taylor, KM; Martinez, D. ; Moore, H. ; Baume, PD ; Simpson, EH ; et coll. L’augmentation de l’expression du récepteur dopaminergique D2 dans le noyau accumbens adulte améliore la motivation. Mol. Psychiatrie 2013 , 18 , 1025-1033. [ Google Scholar ] [ CrossRef ]
- Salamone, JD; Corréa, M. ; Farrar, A. ; Mingote, SM Fonctions liées à l’effort de la dopamine du noyau accumbens et des circuits du cerveau antérieur associés. Psychopharmacologie 2007 , 191 , 461-482. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Berke, JD Que signifie la dopamine ? Nat. Neurosci. 2018 , 21 , 787-793. [ Google Scholar ] [ CrossRef ]
- Yamamoto, BK; Zhu, W. Les effets de la méthamphétamine sur la production de radicaux libres et le stress oxydatif. J. Pharmacol. Exp. Là. 1998 , 287 , 107-114. [ Google Scholar ]
- Bélujon, P. ; Grace, AA Dysfonctionnement du système dopaminergique dans les troubles dépressifs majeurs. Int. J. Neuropsychopharmacol. 2017 , 20 , 1036-1046. [ Google Scholar ] [ CrossRef ]
- Yohn, SE ; Thompson, C. ; Randall, Pennsylvanie ; Lee, Californie ; Müller, CE; Baqi, Y. ; Corréa, M. ; Salamone, JD La tétrabénazine, un inhibiteur du VMAT-2, modifie la prise de décision liée à l’effort, mesurée par la tâche de choix de la barrière du labyrinthe en T : inversion avec l’antagoniste de l’adénosine A2A MSX-3 et le bloqueur de l’absorption des catécholamines, le bupropion. Psychopharmacologie 2015 , 232 , 1313-1323. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Yamada, K. ; Kobayashi, S. ; Numata, T. ; Inagaki, N. Altération des cytokines du transporteur de dopamine : un facteur causal possible dans la fatigue liée au COVID-19. Méd. Hypothèses 2021 , 153 , 110734, Epub avant impression. [ Google Scholar ]
- Hauser, TU ; Fiore, VG; Moutoussis, M. ; Dolan, RJ Psychiatrie computationnelle du TDAH : déficiences du gain neuronal à travers les niveaux d’analyse du mariage. Tendances Neurosci. 2016 , 39 , 63-73. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Haber, SN; Behrens, TEJ Le réseau neuronal sous-jacent à l’apprentissage basé sur les incitations : implications pour l’interprétation des perturbations des circuits dans les troubles psychiatriques. Neurone 2014 , 83 , 1019-1039. [ Google Scholar ] [ CrossRef ]
- Le Héron, C. ; Applications, MAJ ; Husain, M. L’anatomie de l’apathie : Un cadre neurocognitif pour l’amotivation en psychopathologie. Neurosci. Biocomportement. Rév.2020 , 118 , 550-578. [ Google Scholar ]
- Da Cunha, C. ; Gomez-A, A. ; Blaha, CD Le rôle des noyaux gris centraux dans le comportement motivé. Révérend Neurosci. 2012 , 23 , 747-767. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Faites, JP ; Guo, D. ; Ming, GL; Song, H. La régulation positive du BDNF sauve les altérations de la plasticité synaptique induites par le NMDA dans les neurones des granules du gyrus denté de l’hippocampe jeunes et âgés. Apprendre. Mémoire. 2012 , 19 , 89-96. [ Google Scholar ]
- Guo, ZV ; Inagaki, Hong Kong ; Daie, K. ; Druckmann, S. ; Gerfen, CR; Svoboda, K. Maintien de l’activité persistante dans une boucle thalamocorticale frontale. Nature 2015 , 526 , 181-186. [ Google Scholar ] [ CrossRef ]
- Qiu, MH; Vétrivelan, R. ; Plus complet, PM ; Lu, J. Contrôle des noyaux gris centraux du comportement veille-sommeil et activation corticale. EUR. J. Neurosci. 2010 , 31 , 499-507. [ Google Scholar ] [ CrossRef ]
- Lazare, M. ; Chen, JF; Urade, Y. ; Huang, Z.-L. Rôle des noyaux gris centraux dans le contrôle du sommeil et de l’éveil. Curr. Avis. Neurobiol. 2013 , 23 , 780-785. [ Google Scholar ] [ CrossRef ]
- Paterson, RW; Brun, RL; Benjamin, L. ; Nortley, R. ; Wiethoff, S. ; Bharucha, T. ; Jayaseelan, DL; Kumar, G. ; Raftopoulos, RE; Zambreanu, L. ; et coll. Le spectre émergent de la neurologie du COVID-19 : résultats cliniques, radiologiques et de laboratoire. Cerveau 2022 , 143 , 3104-3120. [ Google Scholar ] [ CrossRef ]
- Rudroff, T. ; Vélosam, AC ; Déterre, JR ; Bryant, AD ; Kamholz, J. Long-Fatigue liée au COVID-19 : facteurs contributifs potentiels. Science du cerveau. 2020 , 10 , 1012. [ Google Scholar ] [ CrossRef ]
- Havervall, S. ; Rosell, A. ; Phillipson, M. ; Mangsbo, SM ; Nilsson, P. ; Hober, S. ; Thålin, C. Symptômes et déficience fonctionnelle évalués 8 mois après un léger COVID-19 parmi les travailleurs de la santé. JAMA 2021 , 325 , 2015-2016. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Groff, D. ; Soleil, A. ; Ssentongo, AE ; Ba, DM; Parsons, N. ; Poudel, GR; Lékoubou, A. ; Oh, JS ; Ericson, JE; Sentongo, P. ; et coll. Taux à court et à long terme des séquelles post-aiguës de l’infection par le SRAS-CoV-2 : une revue systématique. JAMA Réseau. Ouvert 2021 , 4 , e2128568. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Davis, S.E. ; Assaf, GS; McCorkell, L. ; Wei, H. ; Faible, RJ ; Re’em, Y. ; Redfield, S. ; Austin, JP ; Akrami, A. Caractérisation du long COVID dans une cohorte internationale : 7 mois de symptômes et leur impact. eClinicalMedicine 2021 , 38 , 101019. [ Google Scholar ] [ CrossRef ]
- Behnood, SA; Shafran, R. ; Bennett, SD; Zhang, AXD; O’Mahoney, LL; Stephenson, TJ ; Ladhani, SN; De Stavola, BL; Viner, RM; Swann, OV Symptômes persistants suite à une infection par le SRAS-CoV-2 chez les enfants et les jeunes : une méta-analyse d’études contrôlées et non contrôlées. J. Infecter. 2022 , 84 , 158-170. [ Google Scholar ] [ CrossRef ]
- Lopez-Léon, S. ; Wegman-Ostrosky, T. ; Perelman, C. ; Sepulvéda, R. ; Rebolledo, Pennsylvanie ; Cuapio, A. ; Villapol, S. Plus de 50 effets à long terme du COVID-19 : une revue systématique et une méta-analyse. Sci. Rep. 2021 , 11 , 16144. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Natelson, BH Fatigue post-infectieuse. Dans Cerveau et comportement : plasticité, compensation et récupération ; Conti, F., Priori, A., Grassi, C., éd.; Springer : Cham, Suisse, 2006 ; Volume 1226. [ Google Scholar ]
- Sigfrid, L. ; Drake, MT; Pauley, E. ; Jesudason, CE; Olliaro, P. ; Lim, WS; Gillesen, A. ; Berry, C. ; Lowe, DJ ; McPeake, J. ; et coll. Long-COVID chez les adultes sortis des hôpitaux britanniques après COVID-19 : une étude de cohorte prospective et multicentrique utilisant le protocole de caractérisation clinique ISARIC de l’OMS. Lancette Reg. Santé EUR. 2021 , 8 , 100186. [ Google Scholar ] [ CrossRef ]
- Gemelli contre le groupe d’étude sur les soins post-aigus du COVID-19. Stratégies de santé mondiales pendant la longue période de COVID-19 : la nécessité d’une approche interdisciplinaire. Clinique vieillissante. Exp. Rés. 2020 , 32 , 1613-1620. [ Google Scholar ] [ CrossRef ]
- Brosschot, JF; Gérin, W. ; Thayer, JF L’hypothèse de la cognition persévérante : un examen de l’inquiétude, de l’activation physiologique prolongée liée au stress et de la santé. J. Psychosom. Rés. 2006 , 60 , 113-124. [ Google Scholar ] [ CrossRef ]
- Thomas, F. Stigmatisation, fatigue et rupture sociale : exploration des impacts du VIH/SIDA sur le bien-être des patients et des soignants dans la région de Caprivi, Namibie. Soc. Sci. Méd. 2006 , 63 , 3174-3187. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Scott, AJ ; Webb, TL; Rowse, G. L’amélioration du sommeil conduit-elle à une meilleure santé mentale ? Un protocole pour une revue méta-analytique d’essais contrôlés randomisés. BMJ Ouvert 2017 , 7 , e016873. [ Google Scholar ] [ CrossRef ]
- Moturu, ST; Khayal, moi; Aharony, N. ; Poêle, J. ; Pentland, A. Utiliser la détection sociale pour comprendre les liens entre le sommeil, l’humeur et le stress. Dans Actes de la conférence internationale annuelle 2011 de l’IEEE Engineering in Medicine and Biology Society, Boston, MA, États-Unis, 9-11 octobre 2011. [ Google Scholar ]
- Fishbain, DA; Cole, B. ; Coutelier, RB ; Lewis, J. ; Rosomoff, HL; Fosomoff, RS La douleur est-elle fatigante ? Un examen structuré fondé sur des données probantes. Douleur Med. 2003 , 4 , 51-62. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Kadetoff, D. ; Kosek, E. Les effets de la contraction musculaire statique sur la pression artérielle, la fréquence cardiaque, les évaluations de la douleur et les seuils de douleur de pression chez les individus en bonne santé et les patients atteints de fibromyalgie. EUR. J. Pain 2007 , 11 , 39-47. [ Google Scholar ] [ CrossRef ]
- Bower, JE Fatigue liée au cancer : mécanismes, facteurs de risque et traitements. Nat. Le révérend Clin. Oncol. 2014 , 11 , 597-609. [ Google Scholar ] [ CrossRef ]
- Manjaly, ZM ; Harrison, Caroline du Nord ; Critchley, HD ; Faites, CT ; Stefanics, G. ; Wenderoth, N. ; Lutterotti, A. ; Müller, A. ; Stephan, KE Mécanismes physiopathologiques et cognitifs de la fatigue dans la sclérose en plaques. J. Neurol. Neurochirurgie. Psychiatrie 2019 , 90 , 642-651. [ Google Scholar ] [ CrossRef ]
- Skrzypczak-Wiercioch, A. ; Sałat, K. Modèle de neuroinflammation induit par les lipopolysaccharides : mécanismes d’action, application de la recherche et orientations futures de son utilisation. Molécules 2022 , 27 , 5481. [ Google Scholar ] [ CrossRef ]
- Ledford, H. L’essai Long COVID offre un espoir provisoire de traitement. Nature 2024 , 601 , 356-357. [ Google Scholar ]
- Sanghavi, D. ; Bansal, P. ; Kaur, IP ; Mughal, MS ; Keshavamurthy, C. ; Cusick, A. ; Schram, J. ; Yarrarapu, SNS ; Giri, AR; Kaur, N. ; et coll. Impact de la colchicine sur la mortalité et la morbidité dans le COVID-19 : une revue systématique. Anne. Méd. 2022 , 54 , 775-789. [ Google Scholar ] [ CrossRef ]
- Saucier, J. ; Comeau, D. ; Robichaud, GA; Chamard-Witkowski, L. Gliose réactive et neuroinflammation : principaux suspects dans la physiopathologie du syndrome neuroCOVID-19 post-aigu. Devant. Neurol. 2023 , 14 , 1221266. [ Google Scholar ] [ CrossRef ]
- Salamone, JD; Corréa, M. ; Farrar, AM; Nunes, EJ; Pardo, M. Dopamine, économie comportementale et effort. Devant. Comportement. Neurosci. 2009 , 3 , 13. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Treadway, MT ; Bossaller, NA; Shelton, RC; Zald, DH Prise de décision basée sur l’effort dans le trouble dépressif majeur : un modèle translationnel d’anhédonie motivationnelle. J. Abnorm. Psycholique. 2012 , 121 , 553-558. [ Google Scholar ] [ CrossRef ]
- Downs, PC ; Blum, K. ; Bagchi, D. ; Kushner, S. ; Bagchi, M. ; Galvin, JM; Lewis, M. ; Siwicki, D. ; Brasseur, R. ; Boyett, B. ; et coll. Avantages pour la santé moléculaire, neurobiologique et systémique de l’obtention de l’homéostasie de la dopamine face à une pandémie catastrophique (COVID-19) : une exploration mécaniste. J. Syst. Intégré. Neurosci. 2020 , 7 . [ Google Scholar ] [ CrossRef ]
- Zhang, JX ; Zhang, JJ Rapport de cas d’amélioration des symptômes de COVID long chez un médecin de l’armée de l’air traité par stimulation magnétique transcrânienne à l’aide de la technique d’impulsion cérébrale électromagnétique. Mil. Méd. 2023 , 188 , e3711–e3715. [ Google Scholar ] [ CrossRef ]
- Linnhoff, S. ; Koehler, L. ; Haghikia, A. ; Zaehle, T. Le potentiel thérapeutique de la stimulation cérébrale non invasive pour le traitement de la fatigue cognitive liée au long COVID. Devant. Immunol. 2023 , 13 , 935614. [ Google Scholar ] [ CrossRef ]
- Noda, Y. ; Sato, A. ; Shichi, M. ; Sato, A. ; Fujii, K. ; Iwasa, M. ; Nagano, Y. ; Kitahata, R. ; Osawa, R. Recherche dans le monde réel sur les stratégies de traitement par stimulation magnétique transcrânienne pour les symptômes neuropsychiatriques du COVID long au Japon. Asiatique J. Psychiatre. 2023 , 81 , 103438. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Roet, M. ; Boonstra, J. ; Sahin, E. ; Mulders, AEP; Leentjens, AFG; Jahanshahi, A. Stimulation cérébrale profonde pour la dépression résistante au traitement : vers une approche thérapeutique plus personnalisée. J. Clin. Méd. 2020 , 9 , 2729. [ Google Scholar ] [ CrossRef ]
- Chase, A. Neuromodulation thérapeutique pour les syndromes de fatigue post-viraux. Stimulation cérébrale. 2023 , 16 , 25-31. [ Google Scholar ]
- Rudroff, T. Les défis de la recherche sur la fatigue liée au long COVID-19. Devant. Psycholique. 2023 , 14 , 1120928. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Vélosam, AC ; Bryant, AD ; Rudroff, T. La fatigue et la fatigabilité perçue, et non la fatigabilité objective, sont répandues chez les personnes atteintes d’une longue COVID-19. Exp. Cerveau Res. 2023 , 241 , 211-219. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Rudroff, T. Révéler la complexité de la fatigue : examen des défis persistants et des promesses de l’intelligence artificielle. Sciences du cerveau. Science du cerveau. 2024 , 14 , 186. [ Google Scholar ] [ CrossRef ] [ PubMed ]
| Avis de non-responsabilité/Note de l’éditeur : Les déclarations, opinions et données contenues dans toutes les publications sont uniquement celles du ou des auteurs et contributeurs individuels et non de MDPI et/ou du ou des éditeurs. MDPI et/ou le(s) éditeur(s) déclinent toute responsabilité pour tout préjudice corporel ou matériel résultant des idées, méthodes, instructions ou produits mentionnés dans le contenu. |
© 2024 par l’auteur. Licencié MDPI, Bâle, Suisse. Cet article est un article en libre accès distribué selon les termes et conditions de la licence Creative Commons Attribution (CC BY) ( https://creativecommons.org/licenses/by/4.0/ ).
Partager et citer